大多数动物在氧化磷酸化过程中利用O2作为主要代谢底物。由于绝对依赖O2的持续供应,动物已经进化出一种在细胞水平上适应缺氧的机制。这是由缺氧诱导因子 (HIF) 的激活介导的。在缺氧条件下,细胞氧需求超过供应,HIF 会保持稳定并诱导 HIF 靶基因的转录,从而促进一系列适应机制,包括通过糖酵解增强无氧 ATP 生成、通过血管生成增加氧供应以及通过红细胞生成增加血液氧合。
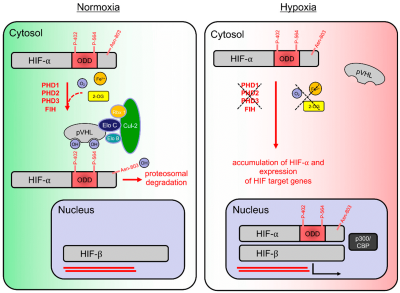
HIF-α 以较高的基础速率合成;然而,一旦合成,只要有足够的非线粒体氧气,它就会迅速降解。HIF 脯氨酰 4-羟化酶 PHD1、PHD2 和 PHD3(也分别称为 EGLN2、EGLN1 和 EGLN3)赋予 HIF-α 亚基以氧气依赖性靶向蛋白酶体降解。在人类中,PHD 可羟基化 HIF-α 亚基上的两个脯氨酸残基 (HIF-1α: Pro402 和 564; HIF-2α: Pro405 和 Pro531),从而触发由 von Hippel-Lindau 肿瘤抑制蛋白 (pVHL)、延长蛋白 B 和 C、Cullin 2 和 RING-box 1 蛋白形成的多聚体 E3 泛素连接酶复合物识别它们。
PHD 需要依靠氧气 (O 2 )、铁 (Fe2+ )、α-酮戊二酸 (也称为 2-草酰戊二酸;2-OG) 和抗坏血酸 (维生素 C) 才能发生羟基化。 PHD在 2-OG 的氧化脱羧过程中利用 O2中的一个氧原子生成琥珀酸和 CO 2,另一个氧原子直接结合到 HIF-α 的氧化氨基酸残基中。PHD 是一种双加氧酶,因为它们将两个分子氧原子都结合到其靶标中。如果细胞内没有足够的 O 2、2-OG 或 Fe2+,PHD 就无法羟基化 HIF-α 亚基以标记它们进行降解。因此,在缺氧条件下,HIF-α 亚基是稳定的,并且可以与 HIF-1β 结合形成具有转录活性的二聚体,从而诱导 HIF 靶基因的转录
因子抑制 HIF (FIH) 是另一种酶,它通过羟基化 HIF-1α 和 2α 的 C 末端转录激活域 (CTAD) 内的天冬酰胺残基 (人类 HIF-1α 中的 Asn803;人类 HIF-2α 中的 Asn851)来抑制常氧条件下的 HIF-α 信号传导。这种羟基化可防止转录辅激活剂组蛋白乙酰转移酶 p300/CREB 结合蛋白 (p300/CBP) 的结合,从而降低 HIF 的羧基末端转录激活域活性。与脯氨酰羟基化一样,FIH 的天冬酰胺酰羟基化在缺氧条件下会减少,从而解除对 HIF 转录激活的抑制。
PHD 酶表现出独特的组织特异性表达模式。在细胞水平上,PHD1 主要在细胞核内表达,而 PHD2 可在细胞质中发现,PHD3 在细胞核和细胞质中均有表达。尽管所有PHD 都普遍表达,但它们的表达水平表现出组织特异性差异。PHD2是表达最丰富的 PHD 酶,几乎存在于所有组织中,而在睾丸和心脏中,PHD1 和 PHD3 分别是表达最高的酶 [ 17 ]。在 HIF 信号转导中,PHD2 是主要的氧传感器。PHD2 基因的纯合缺失与生命不相容,PHD2 的部分缺失 (PHD2 +/− ) 或细胞类型特异性 PHD2 缺失会强烈增加 HIF 表达。相反,临床前研究表明,PHD1 或 3 纯合缺失的动物是可以存活的。对转基因动物的进一步研究为了解单个 PHD 酶在慢性疾病发展过程中的作用提供了有趣的见解。例如,PHD1 缺陷小鼠可免受结肠炎或肝脏病变(如胆道纤维化或缺血/再灌注损伤)的影响。
通过脯氨酰羟基化进行翻译后修饰是一种众所周知的现象。在细胞外胶原蛋白中,超过 30% 的脯氨酸可被羟基化,这是由位于内质网内的胶原脯氨酰羟化酶 (CPH) 家族所致。CPH 由两个不同的酶家族组成,即胶原脯氨酰 4-羟化酶和胶原脯氨酰 3-羟化酶,它们具有不同的功能。然而,由于脯氨酰 4-羟基化是人类中最常见的翻译后修饰,因此在本综述中我们将重点关注脯氨酰 4-羟化酶。
筛选、检测和验证 PHD 或 FIH 介导的翻译后修饰的替代功能靶点在技术上具有挑战性。粗略回顾文献可发现,用于检测和确认 PHD 或 FIH 介导的翻译后修饰的替代靶点的方法和技术存在很大差异。
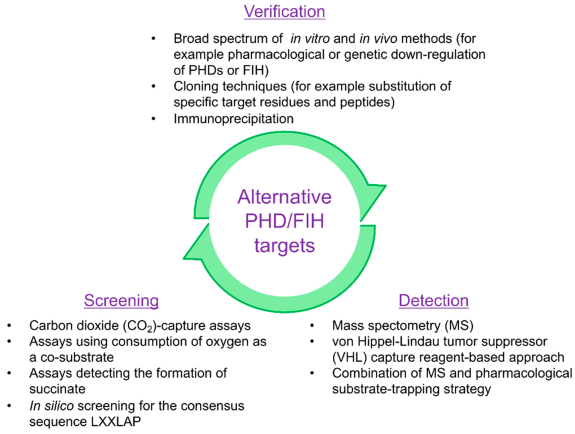
AIMS提供的是高效专业的蛋白羟基化修饰组位点鉴定服务,有专业的HPLC-MS/MS质谱平台,可以分析各种体外培养细胞样本。
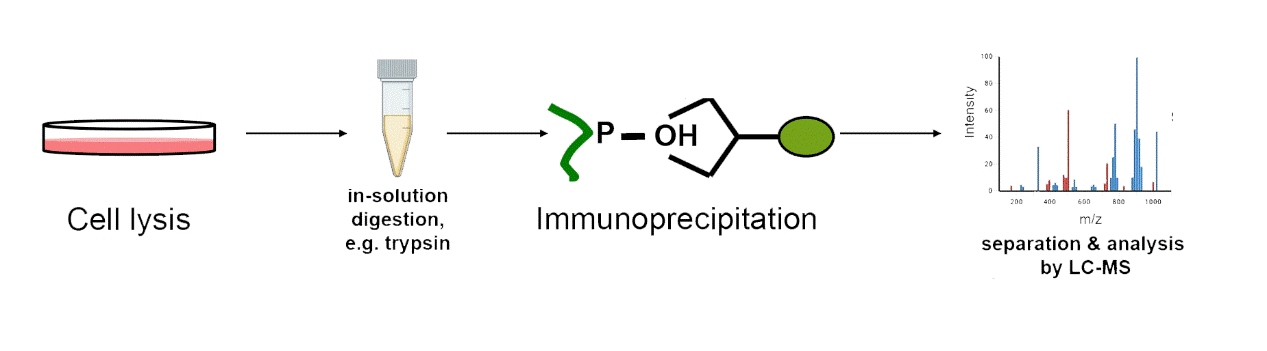
羟基化修饰组学抗体法 |
 |
|
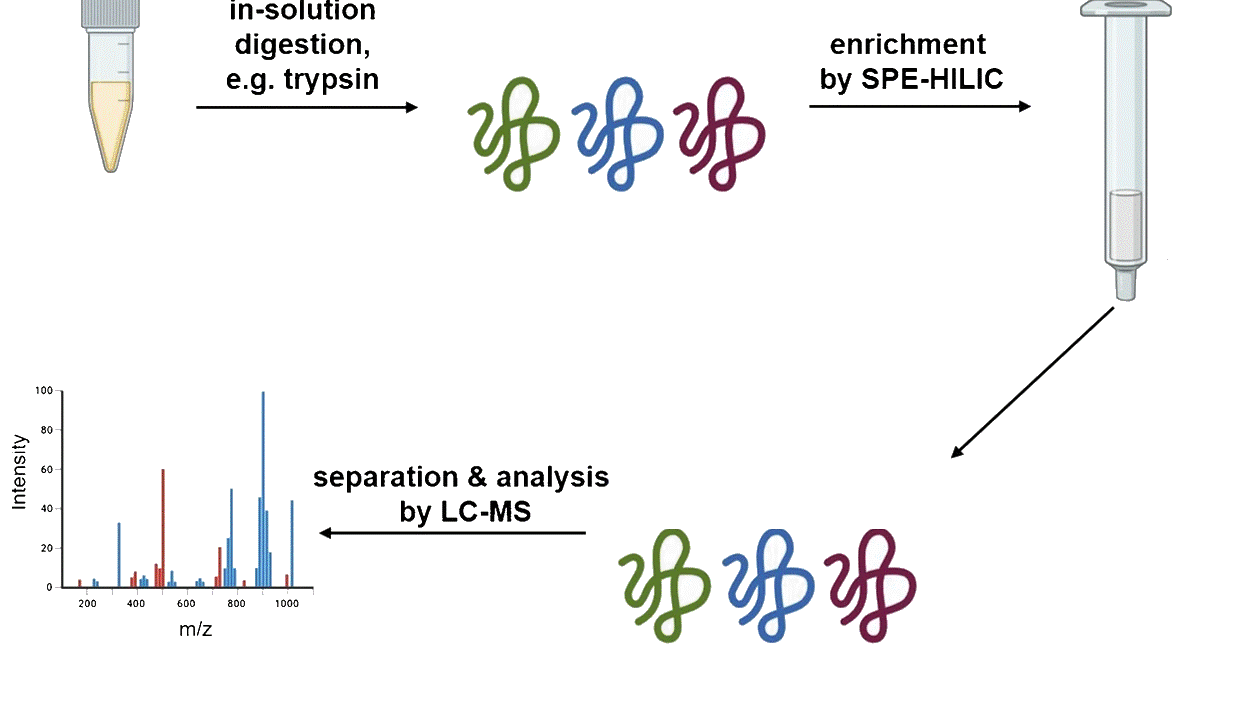
羟基化组学亲和纯化法 |
 |
|
服务流程 |
|