*此项目适合蛋白SUMO化修饰初步定性分析,常规样本为SDS-PAGE和蛋白溶液样本。
SUMO化是一种可逆的蛋白翻译后修饰,经常发生在蛋白的赖氨酸残基,伴随链接着11KDa的泛素类似的调节短肽。最重要的是SUMO化还参与一系列蛋白功能,包括转录因子调控,蛋白相互作用以及蛋白亚细胞定位等。
与泛素化类似的,SUMO化修饰过程需要3种酶的参与协助完成,SUMO-E1(activating enzyme),SUMO-E2(conjugating enzyme),SUMO-E3(Ubi-protein ligase)。随着生物信息学与质谱技术的迅猛发展,精准高通量的方法已经广泛应用于发掘SUMO化修饰底物和位点,这对解密蛋白SUMO化修饰参与的疾病发病机理有重要帮助。
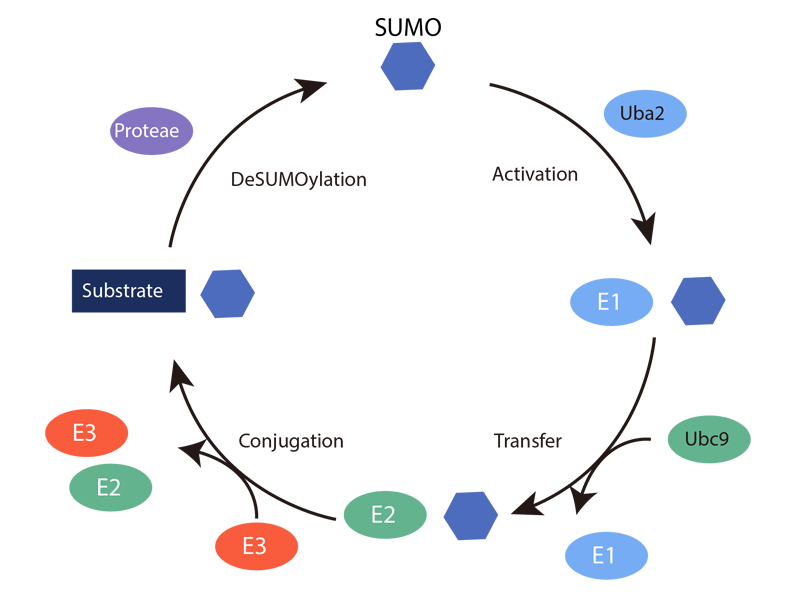
关于细胞内SUMO化修饰的研究发现,SUMO化修饰通过各种方法影响着蛋白的功能,尽管其对蛋白-蛋白相互作用的调控已经被大家认可,但是近期研究发现SUMO化修饰的发生也可能影响着染色质蛋白与DNA,下图中是关于SUMO化修饰DNA结合蛋白后,不同的功能调控。

SUMO化修饰除了会参与蛋白-蛋白,蛋白-DNA相互作用的调控之外,最重要的是更多研究发现蛋白发生SUMO化修饰可能会与人类疾病的发生发展有关,例如,心血管疾病,癌症,神经退行性疾病和免疫疾病。
在我们前面提及的,SUMO化修饰研究手法主要是通过生物信息学与液质联用的结合,可以依赖生信分析预测可能发生的修饰位点。
AIMS提供的是高效专业的蛋白乙酰化鉴定服务,有专业的HPLC-MS/MS质谱平台,可以分析各种真核生物和原核生物样本。

实验流程 |
|
服务流程 |
|