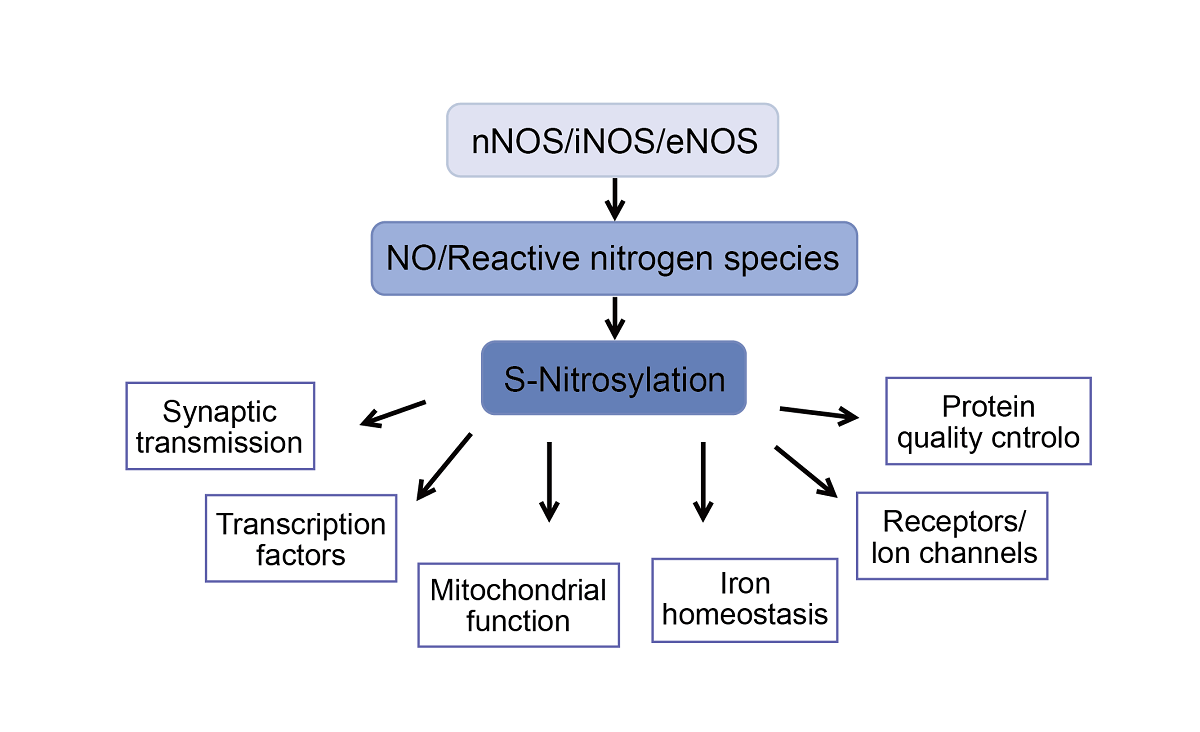
一氧化氮(NO)是诸如血管舒张,血小板聚集抑制,神经传递,抗菌活动等一系列生理学过程的重要调控因子,NO的氧化还原状态及其二原子的化学性质,使其能通过与各种蛋白质发生反应并调控各种细胞内和细胞外事件。很显然,NO修饰反应是通过将亚硝基集团转移至半胱氨酸的巯基上形成S-亚硝基硫醇(SNO),这一过程通常被称之为S-亚硝基化作用。被大家公认的是蛋白发生S-亚硝基化的调控与磷酸化类似,尽管蛋白中的半胱氨酸残基都可发生S-亚硝基化修饰,但是只有很少的修饰是特异性的并且起到调控蛋白功能的作用。
目前最广泛阐明的NO信号通路机制包括对血红素蛋,可溶性鸟苷酸环化酶以及细胞色素C氧化酶的结合和改变。蛋白S-亚硝基化是一种可逆的翻译后修饰,被认为是蛋白质活动,定位,蛋白稳定性和蛋白之间互作的调节剂。
蛋白质的硫醇残基可以通过与NO集团和不同的硫醇底物发生特定反应形成S亚硝基硫醇,其可以直接与NO作用也可通过在硫醇盐和S-亚硝基谷胱甘肽(GSNO)反应时形成。由于此过程的可逆性,后一种化合物GSNO也同样促进S-亚硝基化反应,因此会在氧化还原对GSH/GSNO和氧化还原对蛋白-SH/蛋白-SNO之间产生一种动态平衡。其实GSNOR通过与GSNO反应生成氧化谷胱甘肽二硫化物(GSSG)和氨(NH3),因此而降低S-亚硝基醇的浓度,随后谷氧还蛋白(GRX)通过将GSSG还原为GSH,维护并稳定这个SNO的系统。 当然一氧化氮(NO)分子集团也可以直接转移到蛋白上发生修饰,S-亚硝基硫醇的动态平衡同样依靠于硫氧化还原蛋白/硫氧化还原蛋白还原酶(Trx/TrxR)系统,Trx-介导的SNO蛋白还原化为硫醇是通过对NAPDH的氧化为代价,最终并产生NO去介导相关信号通路。

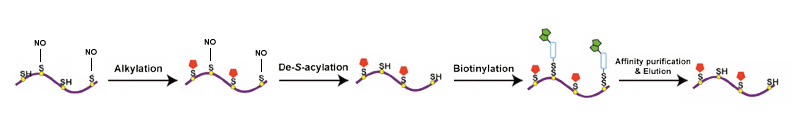
越来越多的研究把焦点放在系统性分析组织,器官和细胞中蛋白的S亚硝基化修饰程度,迄今为止,科学家们已经投入大量工作去理解蛋白S亚硝基化的发生机制,并探索出了几种揭示蛋白S亚硝基化的研究手段。以NO为基础的检测(Saville 检测,化学显影,比色法和荧光法),有机汞和氢化鳞为基础直接捕获,生物素转化法以及液质联用,质谱方法能够对在不同生理和病理情况下的细胞和组织内蛋白的S-亚硝基化程度进行检测。
液质联用(LC-MS/MS)是一种可以定性定量生物杨蓓中SNO和SNO蛋白的有效分析手段,然而直接发现生物体蛋白的SNO位点很具有挑战性,因为S-NO化学键非常不稳定。SNO修饰的多肽通常会看到29Da分子量大小的偏移相比较没有发生修饰的肽段。
实验流程 |
 |
|
服务流程 |
|