*此项目适合细胞活体标记实验,常规样本为各种体外培养细胞样本。
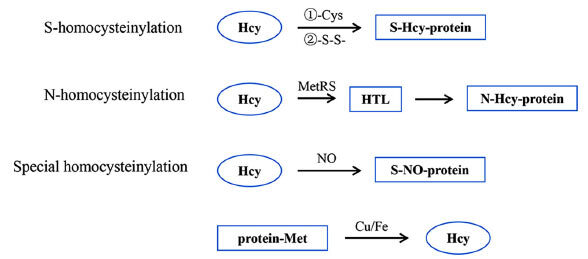
同型半胱氨酸(Hcy)被认为是细胞内两种重要代谢途径交叉点的共同中间体。Hcy与维生素B12一起参与叶酸循环,为核苷酸和氨基酸代谢提供一碳单位。另一条途径是含硫氨基酸代谢,产生蛋氨酸(Met)、半胱氨酸(Cys),甚至同型半胱氨酸化蛋白。然而,人类可用的Hcy来源主要是食物中的必需氨基酸Met。此外,Hcy与目标蛋白结合的过程即为蛋白质同型半胱氨酸化(同型半胱氨酸修饰)。蛋白质同型半胱氨酸化有两种方式:通过异肽键与赖氨酸 (Lys) 残基结合(称为 N-同型半胱氨酸化蛋白质,N-hcy-蛋白质)或通过二硫键与 Cys 残基结合(称为 S-同型半胱氨酸化蛋白质,S-Hcy-蛋白质)。同型半胱氨酸硫内酯 (HTL) 是同型半胱氨酸化的中间产物,并且仅来自 Hcy,因此蛋白质 N-同型半胱氨酸化是 Hcy 与其他氨基酸相比最显著的特征。相反,蛋白质 S-同型半胱氨酸化对 Hcy 不是特异性的,因为相应的 S-硫代化蛋白质是通过形成二硫键产生的,有或没有 Hcy。 N-同型半胱氨酸化是一种新的蛋白质修饰,可能对蛋白质的结构和功能产生负面影响,导致人类疾病的发生。Hcy代谢中先天或后天因素的缺陷会导致N-Hcy蛋白的积累,与心血管和神经退行性疾病有关。
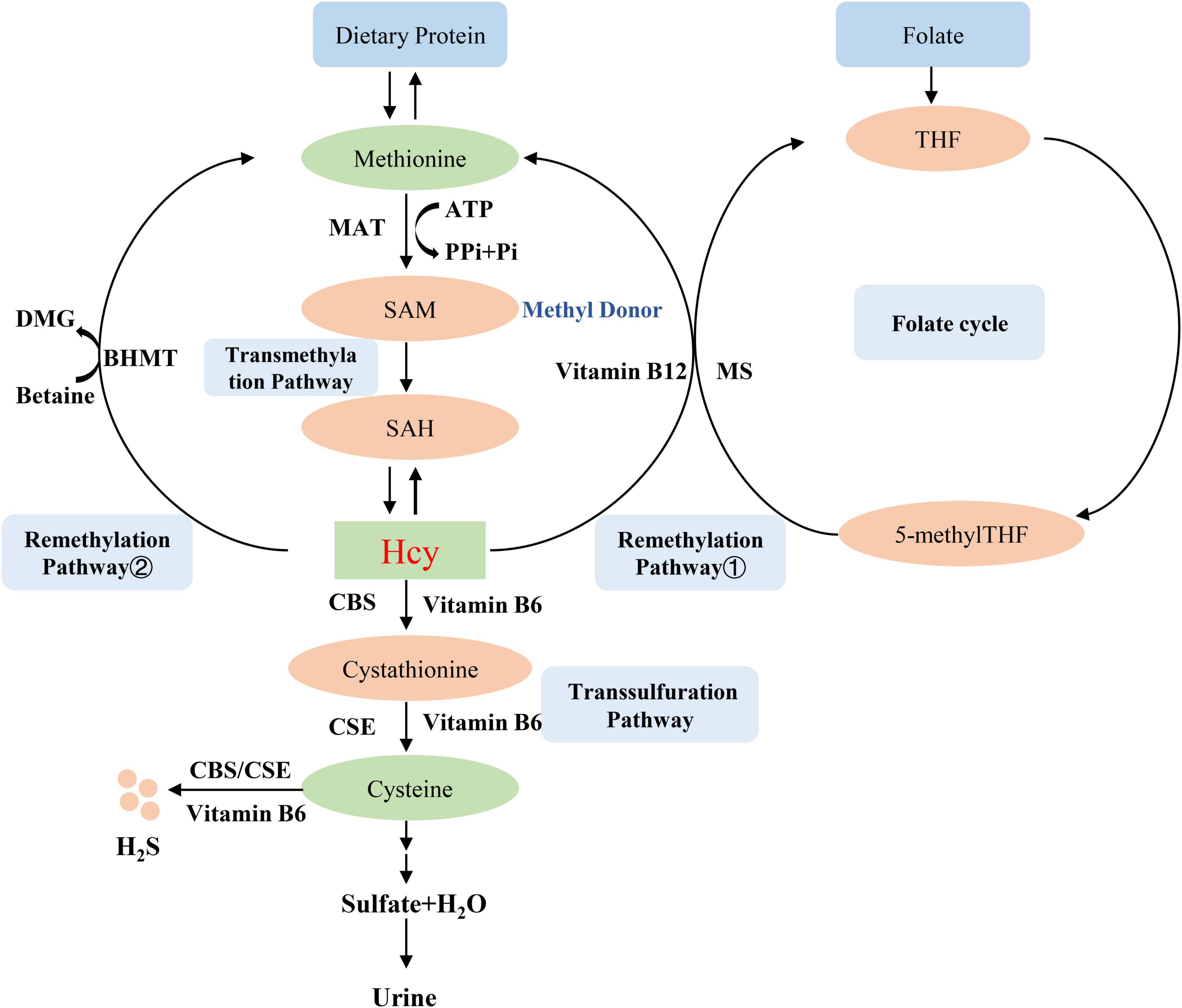
人类中的同型半胱氨酸来源于蛋氨酸。首先,蛋氨酸转化为S-腺苷甲硫氨酸 (AdoMet 或 SAM)。转甲基化后,S-腺苷酸同型半胱氨酸 (AdoHcy 或 SAH) 产物水解为同型半胱氨酸。最后,通过蛋氨酸 tRNA 合成酶 (MetRS) 的错误编辑机制生成同型半胱氨酸硫内酯 (Hcy TL)。由于硫内酯具有高度化学反应性,它很容易与蛋白质中的氨基发生反应,形成稳定的酰胺、同型半胱酰胺或 N-同型半胱氨酸化 (N-Hcy) 蛋白。
目前,分析 N-Hcy 蛋白最常用的方法是将蛋白质完全水解为氨基酸,然后通过 HPLC 分离结合紫外或荧光检测对游离 Hcy 氨基酸进行定量分析。显然,这种方法无法定位修饰位点,不适用于分析复杂生物样本中的许多单个蛋白质。最近,使用抗 N-Hcy 蛋白的多克隆抗体来观察人类心脏组织中的这种修饰。为了确定修饰位点,采用了一种结合蛋白水解消化和质谱的标准方法。由于这种修饰的丰度相对较低,并且分布在给定蛋白质的几个氨基酸残基中,因此只有少数纯化蛋白质经过了检测。考虑到 N-Hcy 蛋白具有与其天然蛋白质不同的化学性质,蛋白质化学方法应该对它们的分析特别有用。
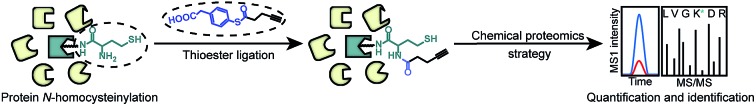
以选择性地用各种醛标签衍生化 N-Hcy 蛋白,从而促进后续的系统和详细分析。我们的方法以醛和 N-同型半胱氨酸化蛋白之间的 1,3-噻嗪加合物形成为中心,更具体地说,是同型半胱氨酸中的 γ-氨基硫醇官能团。荧光或生物素标记可以定量和整体分析生物样本,包括来自大鼠、小鼠和人类的血红蛋白和血浆。更重要的是,可以使用醛树脂亲和富集 N-Hcy 蛋白和肽,从而降低样品的复杂性。使用我们的方法,观察到血红蛋白中赖氨酸残基对Hcy TL 的不同反应性。选择性标记、定量和亲和力富集方法是为蛋白质 N-同型半胱氨酸化的分析提供了一种全面的方法。
AIMS提供的是高效专业的多巴胺蛋白组修饰位点鉴定服务,有专业的HPLC-MS/MS质谱平台,可以分析各种真核生物和原核生物样本。
 |
|
服务流程 |
|