棕榈酰化与TNF途径中的细胞毒性
肿瘤坏死因子(TNF)是一种促炎性细胞因子,在维持组织稳态方面通过调节炎症发挥着关键作用。肿瘤坏死因子与肿瘤坏死因子受体1(TNFR1)结合,通过丝裂原激活蛋白激酶(MAPK)通路和核因子kB(NF-kB)通路触发炎症的转录激活。
肿瘤坏死因子还可以通过诱导细胞死亡间接加剧炎症。在感染期间,肿瘤坏死因子诱导的细胞死亡可能是有益的,它提供细胞外信号,有助于启动适当的免疫反应。然而,它也可能是有害的,导致各种炎症性疾病。受体相互作用丝氨酸/苏氨酸蛋白激酶1(RIPK1)是肿瘤坏死因子通路中的关键节点,它以细胞凋亡和细胞坏死两种不同的调节性细胞死亡机制的形式协调细胞存活和细胞死亡。7-9RIPK1作为分子开关,通过其支架功能诱导炎症和细胞存活,通过其激酶功能在肿瘤坏死因子通路中诱导细胞凋亡和细胞坏死。因此,抑制RIPK1激酶活性的药物目前正在研究中,作为肿瘤坏死因子驱动的人类疾病的潜在替代疗法。
在肿瘤坏死因子(TNF)通路中,S-棕榈酰化是调节RIPK1的激酶活性和细胞毒性潜能的关键修饰。S-棕榈酰化是一种可逆的翻译后修饰,其特征是通过硫酯键将棕榈酸酯共价连接到蛋白质中的半胱氨酸残基上,这一过程由棕榈酰基酰基转移酶(PAT)催化。
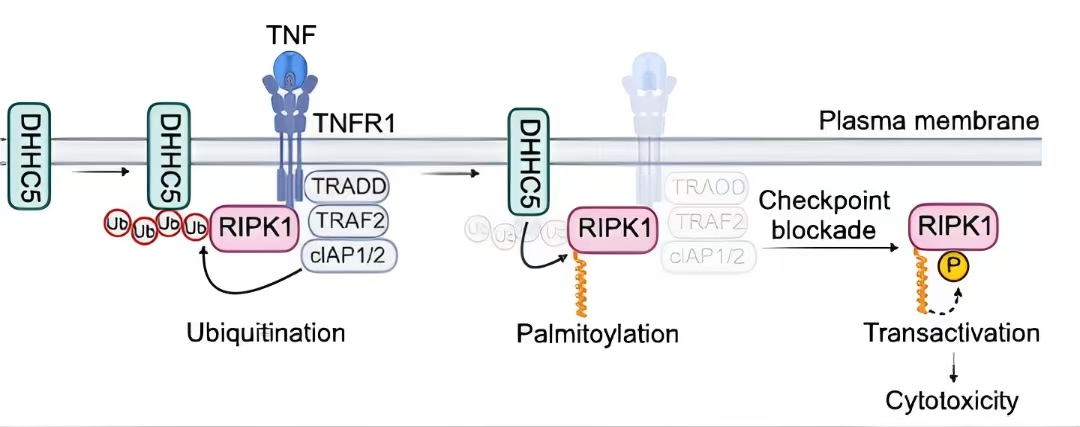
DHHC5介导的RIPK1在肿瘤坏死因子(TNF)刺激下的棕榈酰化反应的示意图模型
RIPK1在肿瘤坏死因子诱导的复合物I中发生S-棕榈酰化
首先确定复合物I的S-棕榈酰化是否是对肿瘤坏死因子(TNF)感知的反应。我们应用了一种常用的酰基-生物素交换(ABE)测定法来检测S-棕榈酰化。这种方法包括阻断蛋白质中的游离半胱氨酸残基,然后使用羟胺(HAM)和硫醇反应性生物素释放并捕获棕榈酰化的半胱氨酸残基(图A)。我们使用免疫沉淀(IP)和基于ABE测定法的富集棕榈酰化蛋白,并结合质谱法,来鉴定复合物I中的S-棕榈酰化底物(图A)。我们确定了复合物I中的三个酰化蛋白,包括RIPK1、TNFR1和TAB3。使用2-溴棕榈酸酯(2-BP)是一种常见的抑制棕榈酰化转移酶(PATs)的方法。只有RIPK1和TNFR1对2-BP处理敏感。我们专注于RIPK1的棕榈酰化,因为RIPK1的棕榈酰化丰度远高于TNFR1的棕榈酰化丰度,并且TNFR1的棕榈酰化之前已被报道过。
然后,我们使用一种带有炔基标签的棕榈酸类似物15-十六碳六烯酸(Alk14)作为代谢标签,它可以通过点击化学与荧光染料TAMRA-叠氮化物或与生物素-叠氮化物结合。过表达的RIPK1在代谢掺入Alk14后发生棕榈酰化。相比之下,在基础条件下,内源性RIPK1未发生棕榈酰化。然而,肿瘤坏死因子(TNF)刺激显著增加了小鼠胚胎成纤维细胞(MEFs)和骨髓来源的巨噬细胞(BMDMs)中RIPK1的棕榈酰化。
RIPK1在进化上保守的半胱氨酸257位点被棕榈酰化
为了鉴定RIPK1的棕榈酰化位点,我们使用了一种优化的ABE检测法,其中免疫纯化的RIPK1的棕榈酰化半胱氨酸用NMM进行标记,随后使用质谱法鉴定NMM标记的半胱氨酸。小鼠RIPK1的主要位点Cys257(人类RIPK1的C256)被明确地鉴定为被NMM标记。值得注意的是,小鼠RIPK1的C257是不同物种中四个保守半胱氨酸之一。我们在Ripk1/小鼠胚胎成纤维细胞中生成RIPK1野生型(WT)和半胱氨酸转丝氨酸突变体重建细胞。在肿瘤坏死因子(TNF)刺激下,将C257突变为丝氨酸(C257S)显著消除了RIPK1的棕榈酰化,而单独或联合突变其他位点(C34S/C268S/C586S或3CS)则影响较小。
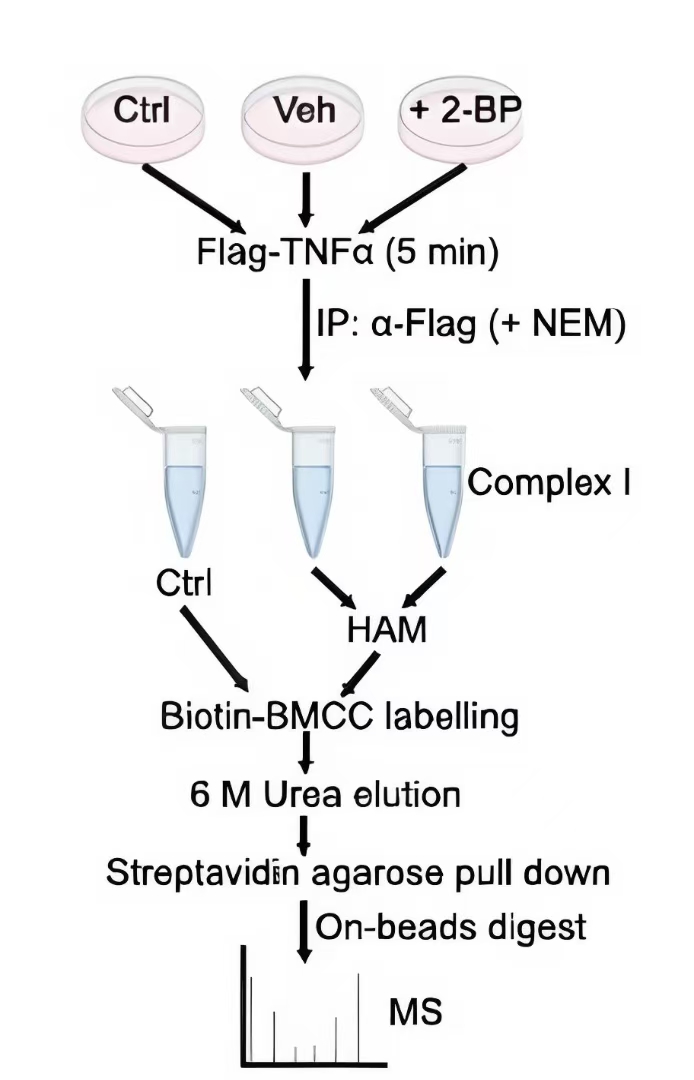
图A
免疫沉淀(IP-WB)
对于在肿瘤坏死因子(TNF)诱导的复合物I中同时免疫沉淀K63和K11连接的泛素链,将小鼠胚胎成纤维细胞(MEFs)接种到培养皿中,用Flag-TNFa处理5分钟。细胞在含有磷酸酶和PI以及NEM的1毫升0.5%NP-40裂解缓冲液中裂解30分钟,然后通过低温高速离心10分钟。用抗FlagM2珠子从澄清的蛋白裂解物中免疫沉淀蛋白质,在4℃下旋转过夜。然后用6摩尔尿素洗脱样本。将所得洗脱液稀释,并在变性条件下(3摩尔尿素)与抗K63泛素抗体或抗K11泛素抗体一起孵育过夜,然后在4℃下与蛋白A/G琼脂糖树脂孵育4小时。然后将免疫复合物洗脱,并通过蛋白质印迹法进行分析。
ABE和APE检测 (Total-ABE-富集-WB)
细胞和组织在裂解缓冲液中裂解,并补充蛋白酶抑制剂。然后,裂解物在4℃下与NEM孵育1.5小时,并通过免疫沉淀法富集RIPK1。珠子用pH值为7.2的裂解缓冲液洗涤三次,并在室温下与新制备的含羟胺(HAM)的裂解缓冲液孵育1小时。
对于ABE检测,将珠子用pH值为6.2的裂解缓冲液洗涤三次,然后在pH值为6.2的裂解缓冲液中于4℃下与生物素-HPD孵育1小时。最后,用pH值为7.5的裂解缓冲液洗涤珠子三次,并用裂解缓冲液中的6摩尔尿素洗脱免疫沉淀物。洗脱液稀释五次,并在室温下与链霉亲和素珠子振荡孵育30分钟,然后用含SDS的PBS洗涤三次。然后将珠子SDS还原上样缓冲液混合,并在95℃下加热10分钟。随后通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离样品,并进行蛋白质印迹分析。对于APE检测,将珠子用pH值为6.2的裂解缓冲液洗涤三次,然后在4℃下与2毫摩尔的PEG-马来酰亚胺在pH值为6.2的裂解缓冲液中孵育1小时。最后,将珠子用pH值为7.5的裂解缓冲液洗涤三次,并与SDS上样缓冲液混合,然后在95℃下加热10分钟。随后,通过SDS-PAGE分离样品,并进行蛋白质印迹分析。
Alk14的点击化学与荧光检测(点击化学)
细胞用50毫摩尔的Alk14或棕榈酸(PA)标记过夜,然后在裂解缓冲液中进行裂解。裂解物低温高速离心10分钟,收集的上清液用于RIPK1的免疫沉淀。孵育后,用D-PBS冲洗三次珠子,然后进行铜(Cu(I))辅助的点击反应,然后用D-PBS冲洗并重新悬浮在D-PBS中,通过荧光显微镜在595纳米处对珠子中的免疫沉淀样本进行分析。
体外S-棕榈酰化测定法(IP-点击化学-洗脱-富集-WB)
对于体外S-棕榈酰化检测,亲和纯化的Flag-DHHC5或其催化失活的突变体与反应缓冲液中的HA-RIPK1珠子一起孵育10分钟。通过加入Alk14-CoA启动反应。反应在室温下振荡1小时。然后,用反应缓冲液洗涤HA-RIPK1珠子,随后用碱性缓冲液洗涤,并进行Cu(I)-辅助点击反应。然后碱性缓冲液洗涤,并用6M尿素处理。洗脱液稀释五倍,并在4℃下与链霉亲和素珠子振荡孵育过夜。珠子用含有1%SDS的PBS洗涤,然后与含有2mM生物素的1/3 SDS上样缓冲液混合,并在95℃下加热10分钟。样品通过SDS-PAGE分离,并进行蛋白质印迹分析。
Aimsmass可提供相关棕榈酰检测、验证试剂盒及相关外包服务
https://www.aimsmass.com/