Chk2激酶是一种较为保守的丝/苏氨酸效应激酶,在DNA损伤反应(DDR)中起重要作用,当传感蛋白识别DNA双链断裂时,传导激酶ATM被激活,使Chk2在T68位置发生磷酸化,然后是Chk2寡聚体化,发生自我磷酸化最终被活化。Chk2下游底物包括p53和细胞周期调节因子,如Cdc25.因此,信号级联确保周期停止,以便在损失无法修复时有足够时间进行DNA修复或者凋亡。
一系列前期发现Chk2在细胞周期中的调控机制,RCA1是Chk2的有丝分裂靶点,并且重要的是Chk2介导的BRAC1磷酸化缺失导致纺锤体缺陷和染色体不稳定,Chk2磷酸化稳定人单级纺锤体1(MPS1)控制着丝点定位,Chk2稳定MPS1并且磷酸化Aurora B激酶的S331位点,防止有丝分裂退出,此篇文章为找出其他Chk2互作蛋白,进行了大规模的Chk2免疫共沉淀实验,并随后进行液质联用方法(LC-MS/MS)分析,发现肌凝蛋白磷酸酶作用MYPT1蛋白。
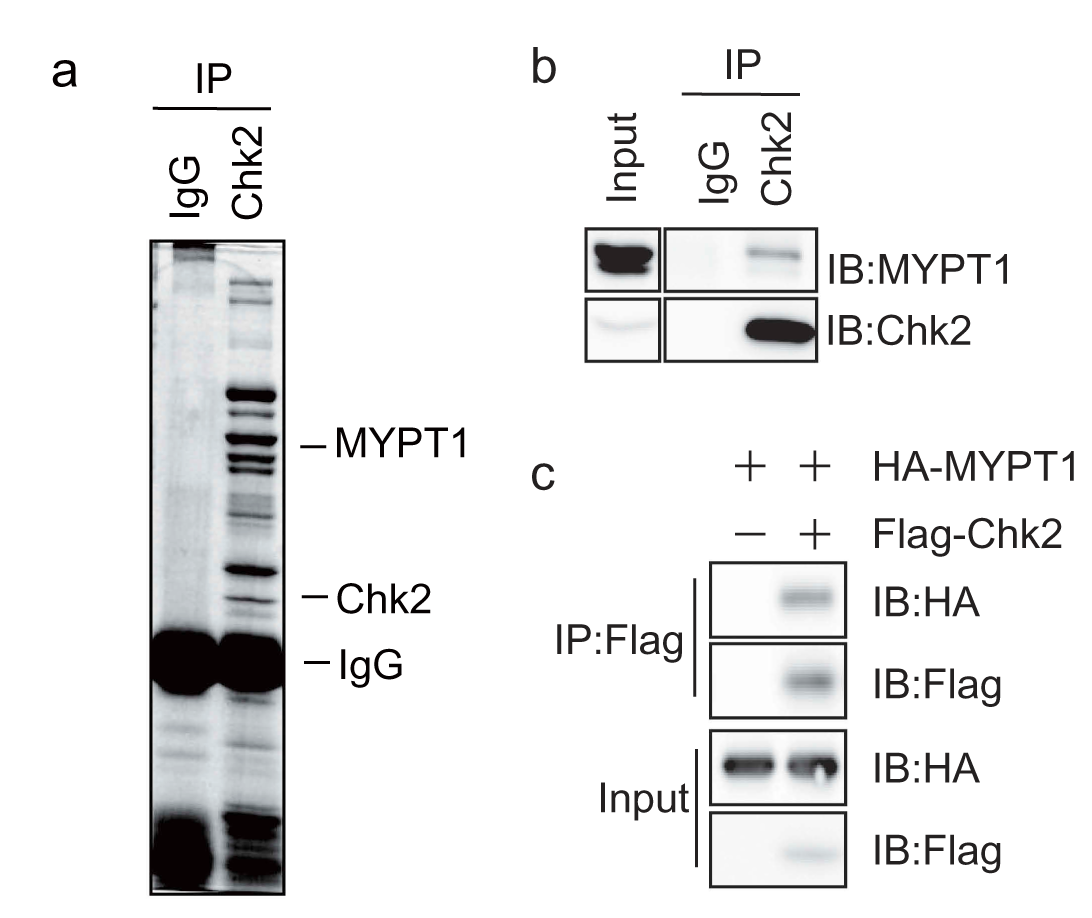
为了鉴定与Chk2相互作用的蛋白,通过Chk2抗体进行免疫共沉降实验)免疫共沉降实验,将结合的蛋白混合物进行考马斯亮蓝染色,如图1a。切割相应条带进行蛋白质谱(LC-MS/MS)分析。在这些蛋白结合物种,鉴定出MYPT1,为进一步分析此相互作用是否真实可靠,在外源性和内源性MYPT1和Chk2之间进行Co-IP实验,如图1b,1c。两种蛋白进行Co-IP实验,综合可说明Chk2可能通过KD与MYPT1相互作用。
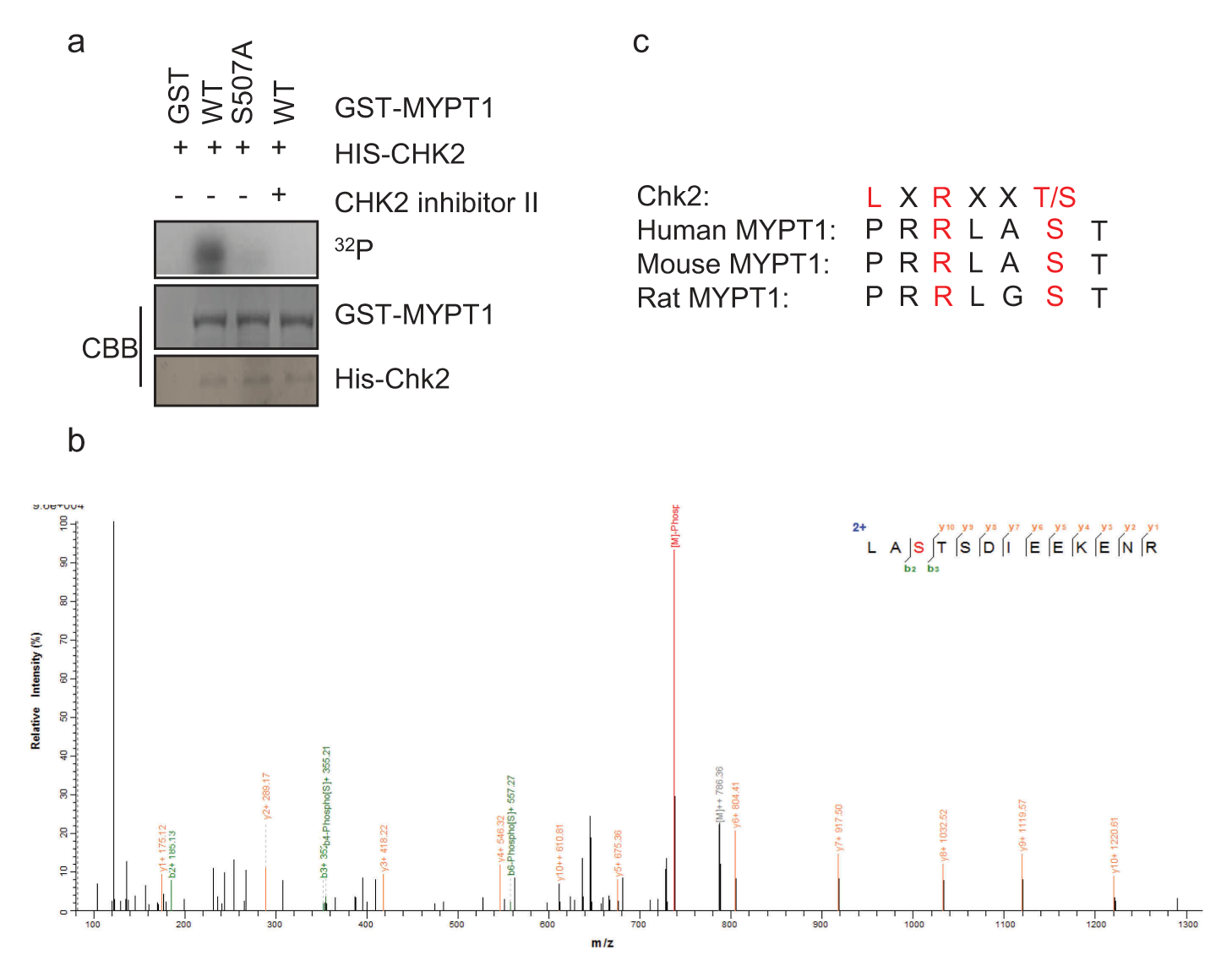
鉴于上述结果,又通过体外激酶实验(IVK),检测了Chk2是否能够磷酸化MYPT1蛋白,如图2所示。发现Chk2蛋白确实能够磷酸化MYPT1,为确定磷酸化位点,对激酶产物进行质谱分析(LC-MS/MS),只确定 了一个位点S507,如图2b所示。
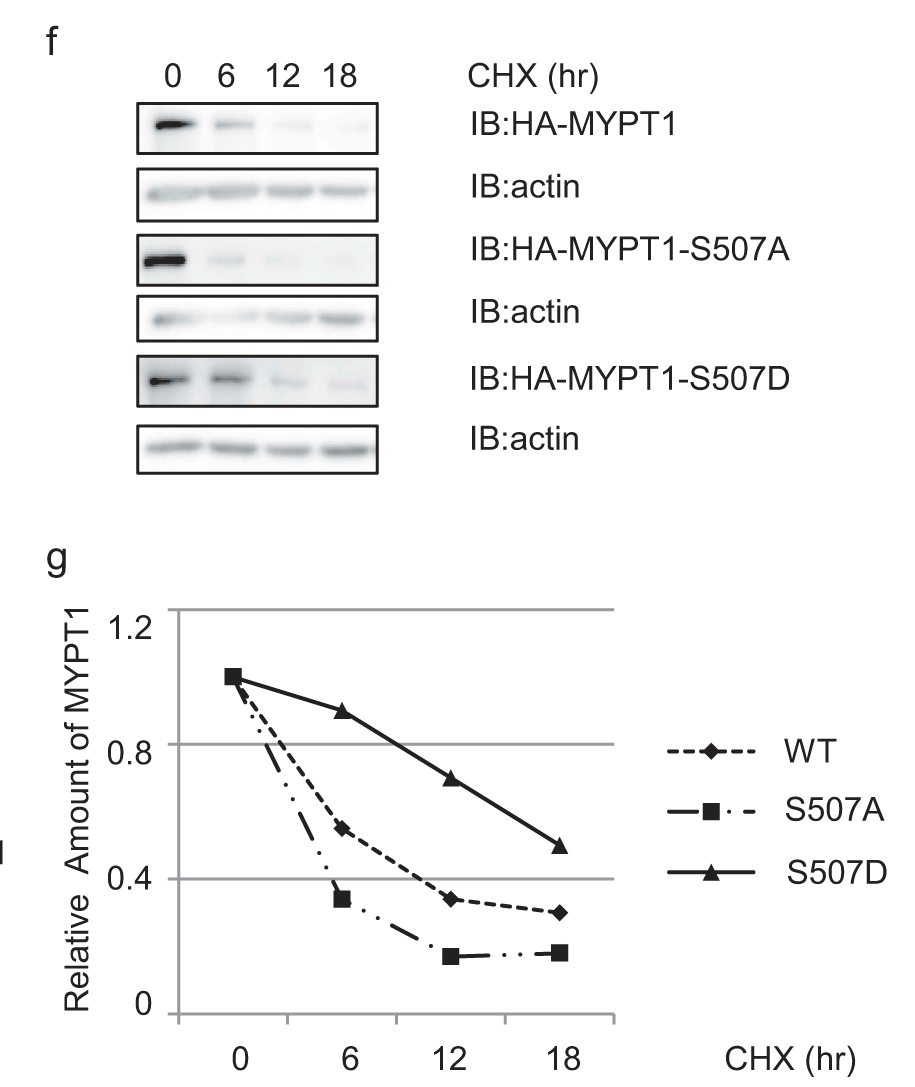
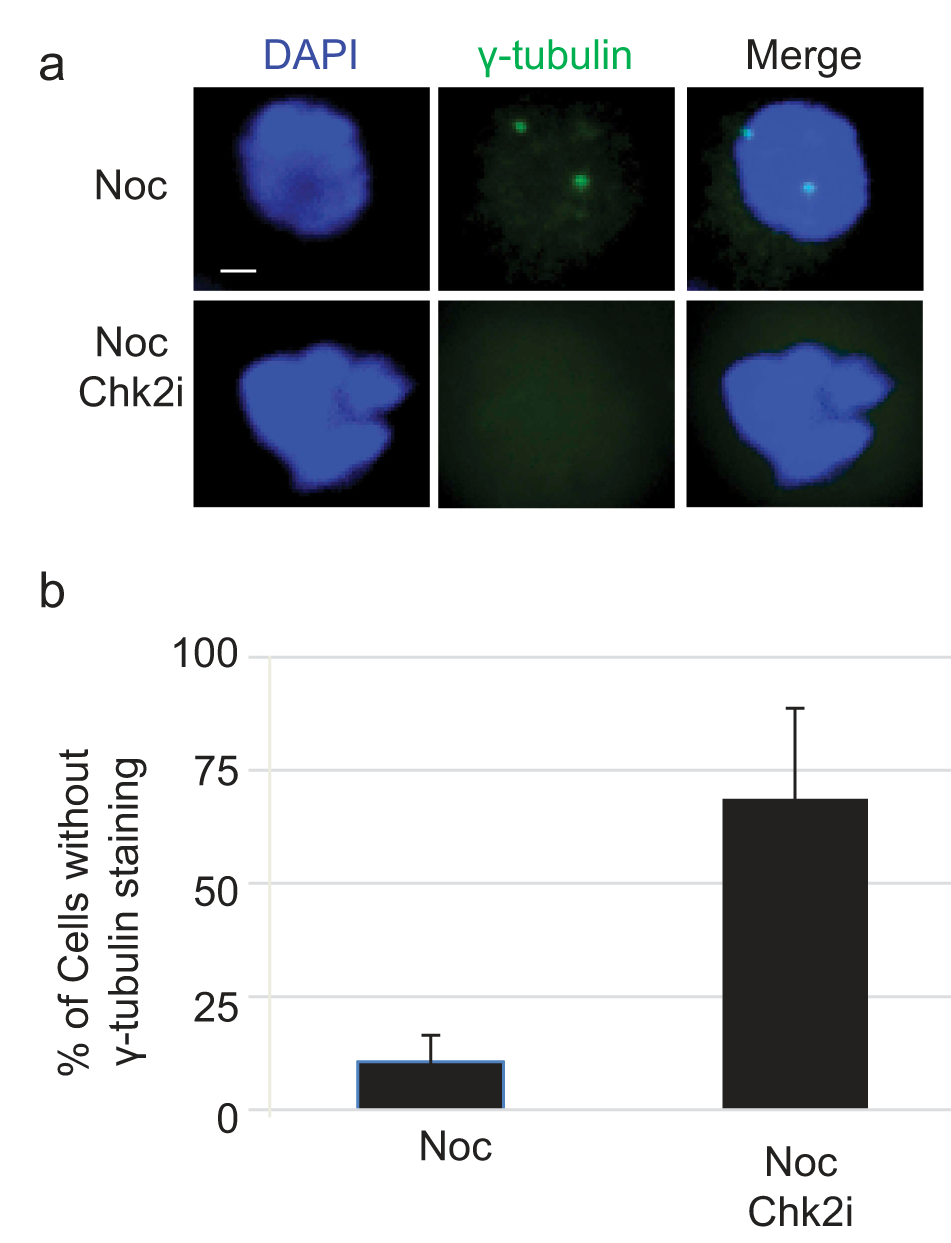
在WT细胞中可以看到定位模式,但在Chk2处理的细胞中没有发现其能够定位,如图4a-b所示。表明Chk2激酶活性是中心体成熟的先决条件。
通过使用Masquant软件对数据进行分析比对,有135个磷酸化位点是较为可信的。 一般来说在质谱峰图中可以在低质量区域看到亚胺离子的很强的信号,会看到m/z为190.037的离子峰的磷酸化组蛋白肽段,如图2b.
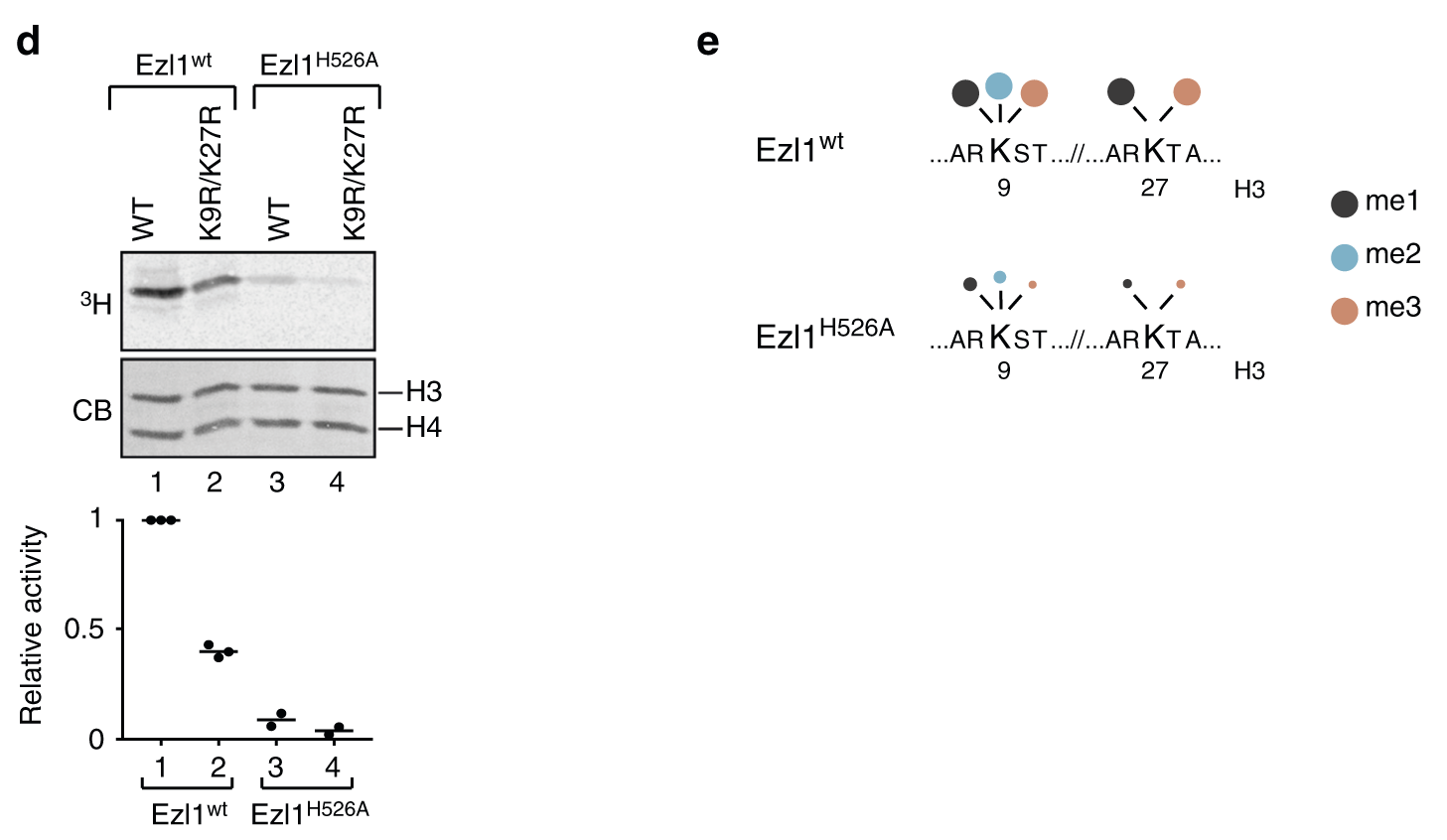
为了进一步研究草履虫H3中哪些赖氨酸残基以ezl1依赖的方式甲基化,我们进行了定量无标记质谱分析。 体外甲基化反应用含有草履虫组蛋白H3的四聚体和Flag-FA双亲和纯化的Ezl1(wt)和Ezl1(H526A),或仅用四聚体作为阴性对照。在此条件下,Ezl1催化K9和K27的三甲基化(图5e,表1,补充数据1)。 我们可以蛋白质谱定性到组蛋白H3 的N端存在其他甲基化位点,尤其是K23,但在催化Ezl1H526A突变体中,只有K9和K27上的甲基化显著降低(表1,图5e)。

检测其他赖氨酸甲基化解释了剩余赖氨酸9和27突变时, 发现在非洲爪蟾蜍或草履虫H3(图2 c, d)。使用蛋白定性质谱分析和K9R / K27R 双突变草履虫组蛋白H3,研究者的确发现K23甲基化位点当赖氨酸9和27不再是酶的底物时候通过依赖蛋白Ezl1发生修饰。总之,所有试验数据支持了赖氨酸9和27都是Ezl1的主要底物的假设,而K23是Ezl1的次要底物,甲基化在体内的相关性需要进一步研究。
为了研究Ezl1在体内的催化活性,作者又进行了基因互补在内源性EZL1基因被敲除的细胞中,表达野生型或突变型的GFP-EZL1转基因,进行检测。在对照条件和EZL1 RNAi条件下,GFP融合蛋白均定位于转化细胞的受精卵MAC中,表明每个RNAi耐药转基因均产生具有正确核定位的融合蛋白。 此研究过程中通过蛋白质谱手段确定了组蛋白的甲基化位点,又通过其他分子生物学手段找到相关试验证据,可见质谱对特定蛋白修饰位点鉴定已成为各研究者的必备手段,AIMS可以提供组蛋白的甲基化位点鉴定服务。
参考文献:SARS coronavirus protein nsp1 disrupts localization of Nup93 from the nuclear pore complex
Aimsmass---蛋白质谱服务商,提供快速便捷的磷酸化位点鉴定服务