蛋白质棕榈酰化在调控细胞蛋白的运输、稳定性和活性方面发挥着多种作用。点击化学的出现推动了蛋白质棕榈酰化领域向前提供特定的,敏感的,快速的,易于处理的方法研究蛋白质棕榈酰化。本文就近十年来蛋白质棕榈酰化的生物学研究进展进行讨论。特别地,我们讨论了点击化学对实现蛋白质棕榈酰化蛋白质组学方法的影响,揭示蛋白质上新的脂质修饰并阐明其功能,以及发展非放射性生化和酶分析。此外,本综述为利用可点击脂肪酸探针构建和探索蛋白质棕榈酰化的新研究途径提供了背景。
蛋白质棕榈酰化在调控细胞蛋白的运输、稳定性和活性方面发挥着多种作用。点击化学的出现推动了蛋白质棕榈酰化领域向前提供特定的,敏感的,快速的,易于处理的方法研究蛋白质棕榈酰化。本文就近十年来蛋白质棕榈酰化的生物学研究进展进行讨论。特别地,我们讨论了点击化学对实现蛋白质棕榈酰化蛋白质组学方法的影响,揭示蛋白质上新的脂质修饰并阐明其功能,以及发展非放射性生化和酶分析。此外,本综述为利用可点击脂肪酸探针构建和探索蛋白质棕榈酰化的新研究途径提供了背景。
可点击的脂肪酸探针的设计是基于在脂肪酸的ω端或甲基端引入一个小的化学标记(炔或叠氮)。小尺寸的化学标记是为了减少对脂肪酰基转移酶底物识别和催化效率的干扰。棕榈酸和肉豆蔻酸的炔和叠氮化物版本已开发用于点击化学使用。Alk-C13(12-十三烯酸)和Alk-C14(13-十四烯酸)主要标记蛋白的肉豆蔻酰化位点,而Alk-C16(15-十六烯酸)和Alk-C18(17-十八烯酸或17-ODYA)标记蛋白的棕榈酰化位点。炔和叠氮化脂肪酸使多个生物发现,如(1)识别蛋白质棕榈酰化网站,(2)揭露棕榈酰蛋白质的亚细胞分布,(3)调查脂肪酰基转移酶的脂肪酸衬底的偏好(4)分析细胞棕榈酰化景观在不同条件下。值得注意的是,其他检测蛋白质棕榈酰化的方法,如酰基生物素交换(ABE)法已被证明对脂肪酰化蛋白的非放射性检测和富集有价值,但它们也有一定的局限性。
ABE试验要求首先阻断所有游离硫醇,然后完全裂解硫酯键,然后进行二硫键形成反应。由于这些步骤,ABE试验不适合测量蛋白质上的棕榈酸盐周转。它只检测s -棕榈酰化,但不揭示蛋白质上的脂质修饰的身份。 它还可能导致误报。另一方面,ABE方法可用于分析天然细胞和组织中的蛋白棕榈酰化,而可点击脂肪酸探针主要用于培养细胞。此外,ABE检测可能覆盖广泛的棕榈酰化蛋白质组,而点击棕榈酸探针检测蛋白质组学研究中代谢标记过程中棕榈酰化的蛋白质。最后,ABE方法和可点击脂肪酸探针目前都不允许棕榈酰化蛋白的活细胞成像分析。
在过去的十年中,基于质谱的定量蛋白质组学方法与点击化学探针的结合为探索蛋白质棕榈酰化在生理和病理通路中的动力学提供了前所未有的机会。
随着az-c14 辅酶A (CoA)的发展,结合质谱分析,科学家首次发现了内源性棕榈酰化蛋白在大鼠肝脏线粒体基质中富集,包括19种新蛋白和2种已知的肝脏线粒体基质蛋白(甲基丙二酰半醛脱氢酶和氨甲酰磷酸合成酶1)。 利用炔烃脂肪酸的代谢标记结合生化检测方法为研究棕榈酰化蛋白提供了一种快速而有力的方法。然而,生化方法的一个局限性是,在细胞裂解液生成过程中,天然亚细胞结构的完整性受到损害,因此提供的棕榈酰化蛋白亚细胞定位信息有限。
点击化学是最通用的生物正交反应之一,已被用来克服生物方法的局限性,使关键的蛋白质-小分子相互作用和翻译后修饰在生物环境中的选择性标记和功能研究成为可能。
生物正交化学-特别是叠氮-炔点击化学-是如何被利用来选择性地标记、测量和鉴定蛋白质、它们的相互作用,以及在自然环境中的修饰。选择性标记、富集和检测蛋白质、它们的相互作用以及它们在天然系统中的修饰的能力是基础生物学研究和药物发现的关键。传统的生物学方法,包括亲和标签的遗传结合和选择性抗体的产生,已经改变了蛋白质的检测。
然而,由于生物物理和技术上的各种原因,他们难以解决蛋白质的相互作用,特别是与小分子,以及许多蛋白质翻译后修饰。这些挑战的发展促使化学正交反应,使蛋白质的选择性化学修饰复杂,原生环境中利用互补的官能团,满足以下条件:(1)官能团不存在于生命系统,(2)是对本地生物惰性组件,和(3)反应生物相容性的条件下(例如,在水环境中,生理pH值和温度、良好的动力学)。这些反应包括两步标记策略。首先,任何蛋白质的选择性标记需要引入bioorthogonal官能团直接到感兴趣的目标(S)。相对规模较小,所需的化学组正交反应可以被纳入小分子,像药物和代谢物,不干扰或修改蛋白质相互作用的能力。在安装“探针”之后,第二步包括使用生物正交反应选择性地安装可视化或富集标记,以便进行后续分析通过凝胶分析,各种成像技术,或液相色谱质谱(LC-MS)方法。
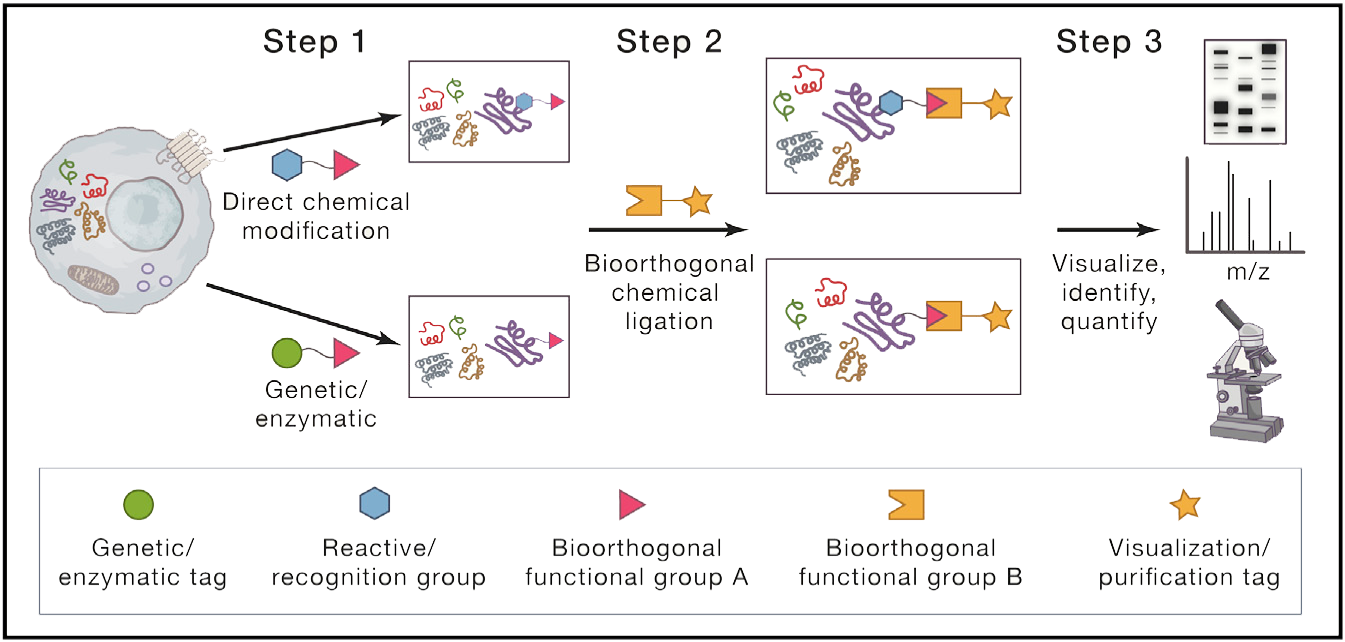
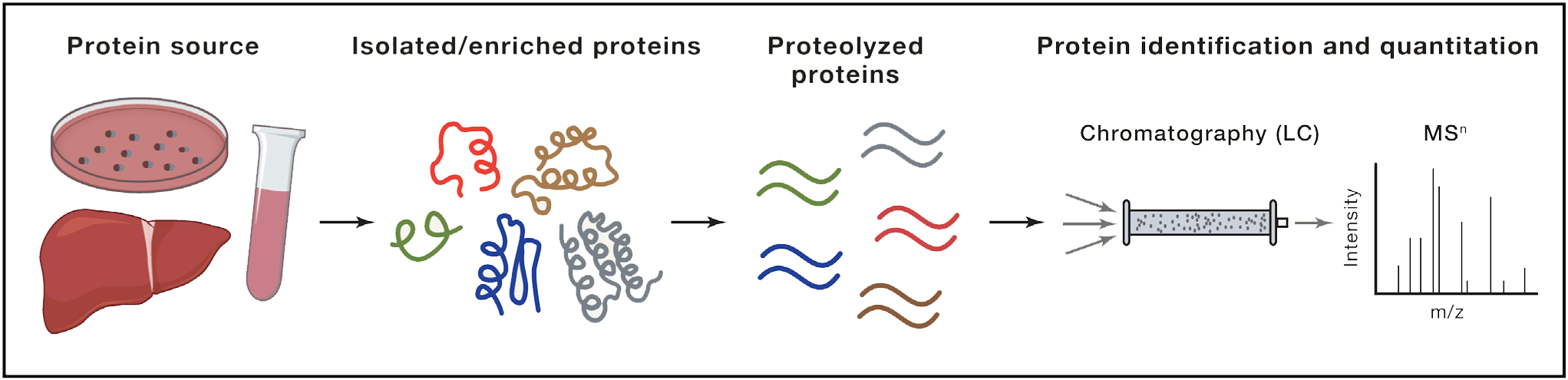
当点击化学与蛋白质组学方法集成时,则可用于选择性标记和丰富蛋白质,以便随后的鉴定和定量。 点击化学的常见应用包括小分子-蛋白质相互作用的映射以及各翻译后修饰。 尽管点击化学的每一种应用都是独特的,但总体总体的工作流程与标准的鸟枪蛋白质组学类似。组织、细胞或裂解物首先用带有叠氮化物或炔的标签处理,用于标记感兴趣的蛋白质。这通常是通过化学探针对内源性蛋白质进行直接化学修饰来实现的。蛋白质也可以通过非天然物质来标记功能化氨基酸的氨基酸诱变或与生物正交基序连接的受体肽。在用一个点击片段标记蛋白质之后,细胞或裂解物将与一个互补的点击官能团连接到一个蛋白质富集标记,如生物素,进行点击反应条件。标记蛋白随后被亲和性基质富集并广泛清洗,通常使用洗涤剂、盐或变性剂。富集的蛋白质然后进行蛋白质水解、分离和质谱工作流程。
部分由于翻译后修饰的作用,蛋白质组比相应的基因组更加多样化。酶和化学修饰可以在各种氨基酸上找到广泛的范围,并在几乎所有的生物过程中发挥关键作用。因此,识别翻译后修饰的蛋白质底物,以及可能的特定修饰位点,对于全面理解细胞生物化学是至关重要的。不幸的是,在鸟枪法蛋白质组学实验中,翻译后修饰通常很难观察到,原因有几个。例如,翻译后修饰通常是亚化学计量的,可以是高度动态的。某些修饰在化学上也是不稳定的,在肽在质谱仪中电离时可能丢失,而其他修饰可以抑制肽片段化和测序。此外,一些翻译后修饰体积大且异质性强,使得用蛋白质组学软件识别它们具有挑战性。考虑到这些因素,在质谱分析之前,翻译后修饰选择性富集是必要的。对于某些翻译后修饰,这可以使用修饰的生物物理特性或更传统的生物工具,如抗体来完成。例如,磷酸化多肽可以使用固定化金属离子亲和层析(IMAC)或金属氧化物基质富集技术允许在人类蛋白质组中鉴定和定量数千个磷酸化位点。在使用抗乙酰赖氨酸抗体富集后,发现了类似数量的赖氨酸乙酰化位点。不幸的是,许多翻译后修饰的特性不能直接富集,许多抗体也不是真正的泛选择性,因此无法富集某些修饰肽序列。
脂化是多种脂肪酸的结合,是控制蛋白质定位和功能的翻译后修饰。更具体地说,这种修饰动态地调节蛋白质在复杂的细胞膜和细胞器网络中的位置,而这些细胞膜和细胞器对细胞功能至关重要。两种最常见的脂化类型是饱和脂肪酸的添加。肉豆蔻酰化通常发生在蛋白质的N端,通过与14碳肉豆蔻酸形成酰胺键进行共翻译。同样,棕榈酰化是可逆的,通常是高度动态的16碳棕榈酸向半胱氨酸侧链的添加,导致脂肪酸硫酯。不饱和脂质也可以通过称为S酰基化的翻译后修饰不可逆地作为硫醚添加到半胱氨酸中。更具体地说,两种不同的类异戊二烯,一种是15碳的法尼酰基,一种是20碳的香叶酰基,可以在某些蛋白质的一两个半胱氨酸中发现,通常是在C端末端。这些翻译后修饰共同控制蛋白质的亚细胞定位,具有多种生物学后果。
与它们复杂的生物学相反,脂类具有化学上一致的结构,基本上没有任何官能团。 这使得创造像抗体这样的传统浓缩工具非常困难。 因此,蛋白质脂化的可视化很大程度上依赖于放射性物质的代谢掺入脂质。同样,对于这项技术,使用小的生物正交处理是绝对必要的,因为这些相对较小的修改可以被细胞代谢和转移酶耐受。这种可能性首次被证实是通过在脂质链的末端用肉豆蔻酸和棕榈酸类似物标记脂化蛋白。这些炔基脂使各种变革性蛋白质组学成为可能。
与它们复杂的生物学相反,脂类具有化学上一致的结构,基本上没有任何官能团。 这使得创造像抗体这样的传统浓缩工具非常困难。 因此,蛋白质脂化的可视化很大程度上依赖于放射性物质的代谢掺入脂质。同样,对于这项技术,使用小的生物正交处理是绝对必要的,因为这些相对较小的修改可以被细胞代谢和转移酶耐受。这种可能性首次被证实是通过在脂质链的末端用肉豆蔻酸和棕榈酸类似物标记脂化蛋白。这些炔基脂使各种变革性蛋白质组学成为可能。
生物正交点击化学已经使广泛的化学探针和报告器的发展成为可能。在许多情况下,使用小的生物正交反应基对于应用探针研究生命系统是至关重要的,而且在所有情况下,通过不同的富集和分析标签的连接,增加了探针的多功能性。尽管许多可点击的探测器都取得了成功,但仍然存在一些挑战。部分由于生物应用的多样性,没有标准化的协议涵盖探针处理、点击化学条件或分析的不同方面。这导致了对各种不同方法的选择,对于新手来说,这些方法可能显得难以承受或武断,因此共享来自专家实验室的详细协议仍然是一个重要的目标。此外,尽管探针和标签的商业供应在过去十年中爆炸性增长,一些试剂和大多数化学探针需要合成化学技术来制备。因此,生物和化学实验室之间的持续密切合作是非常重要的,以确保最好的探针应用于最重要的生物问题。最后,在某些探针应用的下游使用的蛋白质组学分析产生了大量需要分析和管理的数据,这同样需要一些非标准的专业知识、适当的控制和严格的统计评估。
在翻译后修饰的情况下,确定蛋白上修饰的确切位置仍然具有挑战性,而在异质性修饰情况下,确定修饰的确切结构仍然具有挑战性。质谱技术、仪器和数据分析的改进将在未来探测相关发现中发挥关键作用。此外,许多翻译后修饰的探针需要细胞代谢才能产生蛋白质标记。这种对相互关联的生物合成途径的依赖可能导致这些报告因子的代谢转化为“脱靶”途径。因此,一个重要的未来目标应该是更全面地了解探针的代谢和选择性报道的产生通过感兴趣的翻译后修饰通路。最后,继续深入研究化学和生物化学目前尚无靶向翻译后修饰的探针需要开发,在生命的各个领域,这种探针的数量正在不断增加。
Aimsmass---蛋白质谱服务,提供快速便捷的棕榈酰化修饰位点鉴定服务